Giải bài 10 hóa học 9: Một số muối quan trọng
Bài học này trình bày nội dung về một số muối quan trọng. Dựa vào cấu trúc SGK hóa học lớp 9, KhoaHoc sẽ tóm tắt lại hệ thống lý thuyết và hướng dẫn giải các bài tập 1 cách chi tiết, dễ hiểu. Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn.
A - Kiến thức trọng tâm
I. MUỐI NATRI CLORUA NaCl
1. Trạng thái tự nhiên
- Natri clorua có trong nước biển. Cho nước biển bay hơi, ta được chất rắn là hỗn hợp của nhiều muối, thành phần chính là NaCl (trong 1m3 nước biển có hòa tan chừng 27kg NaCl, 5kg MgCl, 1kg CaSO4 và một khối lượng nhỏ những muối khác).
- Ngoài ra, trong long đất cũng chứa một khối lượng muối natri clorua kết tinh gọi là muối mỏ.
- Những mỏ muối có nguồn gốc từ những hồ nước mặn đã cạn đi từ hàng triệu năm.
2. Cách khai thác
- Ở những nơi có biển hoặc hồ nước mặn, người ta khai thác NaCl từ nước mặn trên. Cho nước mặn bay hơi từ từ, thu được muối kết tinh.
- Ở những nơi có mỏ muối, người ta đào hầm hoặc giếng sâu đến mỏ muối để lấy muối lên.
- Muối mỏ sau khi khai thác, được nghiền nhỏ và tinh chế để có muối sạch.
3. Ứng dụng
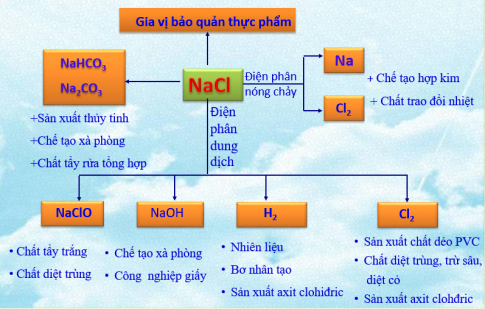
Muối NaCl có rất nhiều ứng dụng trong đời sống và sản xuất
II. KALI NITRAT KNO3
1. Tính chất
- KNO3 là chất rắn, tan nhiều trong nước, khi tan thu nhiệt,
- KNO3 bị nhiệt phân: 2KNO3
 2KNO2 + O2
2KNO2 + O2
2. Ứng dụng
- KNO3 dừng chế tọ thuốc nổ, làm phân bón, bảo quản thực phẩm trong công nghiệp.
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Kiến thức thú vị
Câu 1.(Trang 36)
Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
a) Không được phép có trong nước ăn vì tính độc hại của nó?
b) Không độc nhưng cũng không nên có trong nước ăn vì vị mặn của nó?
c) Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
d) Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Câu 2.(Trang 36 SGK)
Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai dung dịch chất ban đầu có thể là những chất nào. Minh họa bằng các phương trình hóa học.
Câu 3.(Trang 36 SGK)
a) Viết phương trình điện phân dung dịch muối ăn (có màng ngăn).
b) Những sản phẩm của sự điện phân dung dịch NaCl ở trên có nhiều ứng dụng quan trọng:
- Khí clo dùng để: 1)…, 2)…, 3)…
- Khí hidro dùng để:1)…, 2)…, 3)…
- Natri hiđroxit dùng để: 1)…, 2)…, 3)…
Điền những ứng dụng sau đây vào những chỗ để trống ở trên cho phù hợp:
Tẩy trắng vải, giấy; nấu xà phòng; sản xuất axit clohiđric; chế tạo hóa chất trừ sâu, diệt cỏ dại; hàn cắt kim loại; sát trùng, diệt khuẩn nước ăn; nhiên liệu cho động cơ tên lửa; bơm khí cầu, bóng thám không; sản xuất nhôm, sản xuất chất dẻo PVC; chế biến dầu mỏ.
Câu 4.(Trang 36 SGK)
Dung dịch NaOH có thể dùng để phân biệt 2 muối có trong mỗi cặp chất sau được không? (nếu được thì ghi dấu (x), Nếu không thì ghi dấu (o) vào các ô vuông).
a) Dung dịch K2SO4 và dung dịch Fe2(SO4)3.
b) Dung dịch Na2SO4 và dung dịch CuSO4.
c) Dung dịch NaCl và dung dịch BaCl2.
Viết các phương trình hóa học, nếu có.
Câu 5.(Trang 36 SGK)
Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.
a) Viết các phương trình hóa học đối với mỗi chất.
b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.
c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.
Các thể tích khí được đo ở điều kiện tiêu chuẩn.
Xem thêm bài viết khác
- Giải câu 5 bài 45: Axit axetic
- Giải câu 1 bài 39: Dẫn xuất halogen của hidrocacbon sgk trang 177
- Giải câu 3 bài 24: Ôn tập học kì 1
- Giải câu 4 bài 56: Ôn tập cuối năm Phần 2
- Giải câu 5 bài 54: Polime
- Giải bài 50 hóa học 9: Glucozơ
- Giải câu 3 bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Giải câu 2 bài 3: Tính chất hóa học của axit
- Giải câu 2 bài 19: Sắt
- Giải bài 47 hóa học 9: Chất béo
- Giải câu 5 bài 18: Nhôm
- Giải câu 1 bài 46: Mối liên hệ giữa etilen, rượu etylic và axit axetic












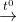 2KNO2 + O2
2KNO2 + O2