Giải bài 14: Bài thực hành 2 -Tính chất của một số hợp chất nitơ, photpho
Nhằm áp dụng kiến thực lí thuyết vào thực tiễn. KhoaHoc chia sẻ tới các bạn Bài thực hành 2: Tính chất của một số hợp chất nitơ. Phản ứng trao đổi ion trong dung dịch các chất điện li. Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn
Bài học gồm hai phần:
- Lý thuyết về tính chất của một số hợp chất nitơ, photpho
- Giải các thí nghiệm SGK
A. Lý thuyết
1. Hợp chất của nitơ
a, Amoniac (NH3)
* Có tính bazơ yếu:
- Tác dụng với H2O giải phóng OH- và dẫn điện
![]()
- Tác dụng với dung dịch muối tạo thành kết tủa hiđroxit. Ví dụ
AlCl3 + 2NH3 + 3H2O → Al(OH)3 + 3NH4Cl
- Tác dụng với axit tạo muối amoni
NH3 + HCl → NH4Cl
* Tính khử
- Tác dụng với oxi
![]()
- Tác dụng với clo
NH3 + 3Cl2 → N2 + 6HCl
b, Muối amoni (![]() )
)
- Tác dụng với dung dịch kiềm (Phản ứng nhận biết ion amoni):
![]()
- Phản ứng nhiệt phân:
Muối amoni chứa gốc axit không có tính oxi hóa:
![]()
(NH4)2CO3 → 2NH3 + CO2 + H2O
Muối amoni chứa gốc của axit có tính oxi hóa:
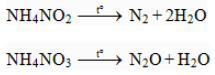
c, Axit nitric
* Tính axit
HNO3 → H+ + NO3-
- Làm quỳ tím hoá đỏ
- Tác dụng với bazơ. VD: HNO3 + NaOH → NaNO3 + H2O
- Tác dụng với oxit bazơ. VD: 2HNO3 + MgO → Mg(NO3)2 + H2O
- Tác dụng với muối. VD: 2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
* Tính oxi hóa
- Tác dụng với kim loại (trừ Au, Pt)
Cu + 4HNO3 (đặc) → Cu(NO3)2 + 2NO2 + 2H2O
- Tác dụng với phi kim:
![]()
- Tác dụng với hợp chất
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
d, Muối nitrat
* Tính chất vật lí
- Tất cả các muối nitrat đều là chất rắn, dễ tan trong nước và là điện li mạnh.
* Phản ứng nhiệt phân
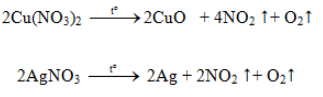
2. Hợp chất của photpho
a, Axit photphoric
- Tác dụng với dung dịch kiềm
H3PO4 + NaOH → Na H2PO4 + H2O
H3PO4 + NaOH → Na2 HPO4 + 2H2O
H3PO4 + NaOH → Na 3PO4 + 3H2O
b, Muối photphat
- Các muối trung hòa và các muối acid của kim loại Natri, Kali nà Amoni đều tan trong nước.
- Với các kim loại khác, chỉ có muối dihidrophotphat là tan được, ngoài ra đều không tan hoặc ít tan trong nước.
- Phản ứng nhận biết:
3Ag+ + PO43- → Ag3PO4↓
(màu vàng)
B. Giải các thí nghiệm SGK
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Kiến thức thú vị
Thí nghiệm 1: Tính oxi hóa của axit nitric đặc và loãng
- Quan sát màu của khí bay ra và màu của dung dịch trong mỗi ống nghiệm.
- Giải thích và viết các phương trình hóa học.
Thí nghiệm 2: Tính oxi hóa của muối kali nitrat nóng chảy
- Quan sát sự cháy tiếp tục của hòn than.
- Giải thích hiện tượng và viết phương trình hóa học.
Thí nghiệm 3: Phân biệt một số loại phân bón hóa học
a) Phân đạm amoni sunfat tác dụng với dung dịch NaOH. Viết phương trình hóa học của phản ứng xảy ra dưới dạng phương trình ion rút gọn.
b) Phân kali clorua và phân supephotphat kép tác dụng với dung dịch AgNO3. Giải thích và viết phương trình hóa học của các phản ứng.
Xem thêm bài viết khác
- Giải câu 1 bài 15: Cacbon
- Danh pháp các hợp chất hữu cơ Cách đọc tên hợp chất hữu cơ
- Giải bài 32 Ankin sgk Hóa học 11 trang 139
- Giải câu 10 bài 35 Benzen và đồng đẳng. Một số hidrocacbon thơm khác sgk Hóa học 11 trang 160
- Giải câu 1 bài 10: Photpho
- Giải câu 3 bài 20: Mở đầu về hóa học hữu cơ
- Giải câu 5 bài 19 Luyện tập: Tính chất của cacbon, silic và hợp chất của chúng
- Giải câu 2 bài 2: Axit, bazơ, muối
- Giải câu 8 bài 35 Benzen và đồng đẳng. Một số hidrocacbon thơm khác sgk Hóa học 11 trang 160
- Giải câu 2 bài 26: Xicloankan sgk Hóa học trang 120
- Giải câu 2 bài 42 hóa 11: Luyện tập : Dẫn xuất halogen, ancol và phenol sgk trang 195
- Giải câu 6 bài 29: Anken sgk Hóa học 11 trang 132











