Giải thí nghiệm 1 bài 27: Bài thực hành số 2: Tính chất hóa học của khí clo và hợp chất của clo
Thí nghiệm 1: Điều chế khí Clo – Tính tẩy màu của khí clo ẩm
- Quan sát hiện tượng xảy ra.
- Giải thích và viết phương trình hóa học.
Bài làm:
Thí nghiệm 1: Điều chế khí Clo – Tính tẩy màu của khí clo ẩm
Dụng cụ, hóa chất:
- Dụng cụ: ống nghiệm, nút cao sụ, kẹp gỗ,…
- Hóa chất: Tinh thể KMnO4, dung dịch HCl đậm đặc, giấy quỳ.
Cách tiến hành:
- Cho vào ống nghiệm khô một vài tinh thể KMnO4, nhỏ tiếp vào ống nghiệm vài giọt dung dịch HCl đặc.
- Đậy nhanh ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm.
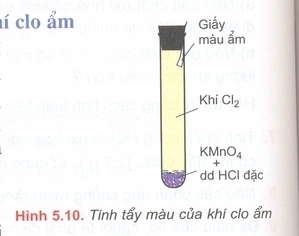
Hiện tượng – giải thích:
- Hiện tượng: Có khí màu vàng thoát ra. Quỳ tím ẩm dần dần bị mất màu.
- Giải thích: Khí màu vàng là do clo được tạo thành do phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Sau đó clo tan vào nước tạo ra HClO (axit có tính oxi hóa mạnh) làm mất màu quỳ tím.
Cl2 + H2O ⥩ HCl + HClO
Xem thêm bài viết khác
- Giải câu 1 bài 4: Cấu tạo vỏ nguyên tử
- Giải câu 6 bài 16: Luyện tập Liên kết hóa học
- Giải bài 26 hóa học 10: Luyện tập: Nhóm halogen
- Giải bài 1 hóa học 10: Thành phần nguyên tử
- Giải câu 7 bài 38: Cân bằng hóa học
- Giải câu 1 bài 11: Luyện tập Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Giải câu 4 bài 18: Phân loại phản ứng trong hóa học vô cơ
- Giải câu 2 bài 1: Thành phần nguyên tử
- Giải bài 25 hóa học 10: Flo Brom Iot
- Giải câu 1 bài 38: Cân bằng hóa học
- Giải câu 6 bài 15: Hóa trị và số oxi hóa
- Giải câu 8 bài 34: Luyện tập: Oxi và lưu huỳnh











