Giải bài 11 hóa học 10: Luyện tập Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
Bài học này trình bày nội dung: Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấy hình electron nguyên tử và tính chất của các nguyên tố hóa học . Dựa vào cấu trúc SGK hóa học lớp 9, KhoaHoc sẽ tóm tắt lại hệ thống lý thuyết và hướng dẫn giải các bài tập 1 cách chi tiết, dễ hiểu. Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn.
A – KIẾN THỨC TRỌNG TÂM
1.Cấu tạo bảng tuần hoàn
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng ngang (chu kì.
- Các nguyên tố có cùng số electron hóa trị (electron có khả năng tham gia vào quá trình hình thành liên kết hóa học) được xếp thành một cột (nhóm).
Ô nguyên tố: Mỗi nguyên tố xếp vào một ô
Chu kì
- Mỗi hàng là 1 chu kì
- Có 7 chu kì: 3 chu kì nhỏ: là các chu kì 1, 2, 3 và 4 chu kì lớn: là các chu kì 4, 5, 6, 7.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
Nhóm nguyên tố
- Nhóm A bao gồm các nguyên tố s và nguyên tố p
- Nhóm B bao gồm các nguyên tố d và nguyên tố f
2.Sự biến đổi tuần hoàn
Cấu hình electron của nguyên tử
- Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A được lặp đi lặp lại sau mỗi chu kì, ta nói rằng: Chúng biến đổi một cách tuần hoàn.
Sự biến đổi tuần hoàn tính kim loại, tính phi kim, bán kính nguyên tử và giá trị độ âm điện củ các nguyên tố được tóm tắt trong bảng sau:
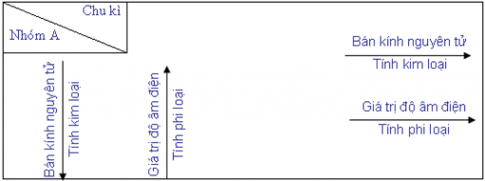
3. Định luật tuần hoàn các nguyên tố.
- Tính chất của các nguyên tử cũng như thành phần tính chất các đơn chất và hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Kiến thức thú vị
Câu 1.(Trang 53 SGK)
a) Căn cứ vào đâu mà người ta xếp các nguyên tố thành chu kì, nhóm ?
b) Thế nào là chu kì ? Bảng tuần hoàn có bao nhiêu chu kì nhỏ, bao nhiêu chu kì lớn ? Mỗi chu kì có bao nhiêu nguyên tố ?
Câu 2.(Trang 53/sgk)
Tìm câu sai trong những câu dưới đây:
A. Trong chu kì, các nguyên tố được xếp theo chiều điện tích hạt nhân tăng dần.
B. Trong chu kì, các nguyên tố được sắp xếp theo chiều số hiệu nguyên tử tăng dần.
C. Nguyên tử của các nguyên tố trong cùng một chu kì có số electron bằng nhau.
D. Chu kì thường bắt đầu là một kim loại kiềm, kết thúc là một khí hiếm (trừ chu kì 1 và chu kì 7 chưa hoàn thành).
Câu 3.(Trang 54 SGK)
Từ trái sang phải trong một chu kì, tại sao bán kính nguyên tử các nguyên tố các nguyên tố giàm thì tính kim loại giảm, tính phi kim tăng ?
Câu 4.(Trang 54 SGK)
Trong bảng tuần hoàn, các nhóm A nào gồm hầu hết các nguyên tố kim loại, nhóm A nào gồm hầu hết các nguyên tố phi kim, nhóm A nào gồm các nguyên tố khí hiếm ? Đặc điểm số electron lớp ngoài cùng của các nguyên tử trong các nhóm trên.
Câu 5.(Trang 54 SGK)
Tổng số hạt proton, nơtron, electron của nguyên tử của một nguyên tố thuộc nhóm VIIA là 28.
a) Tính nguyên tử khối.
b) Viết cấu hình electron nguyên tử của nguyên tố đó.
Câu 6.(Trang 54 SGK)
Một nguyên tố thuộc chu kì 3, nhóm VIA trong bảng tuần hoàn.
a) Nguyên tử của nguyên tố đó có bao nhiêu electron ở lớp electron ngoài cùng ?
b) Lớp electron ngoài cùng là lớp electron thứ mấy ?
c) Viết số electron ở từng lớp electron.
Câu 7.(Trang 54 SGK)
Oxit cao nhất của một nguyên tố là RO3, trong hợp chất của nó với hiđro có 5,88% H về khối lượng. Xác định nguyên tử khối của nguyên tố đó.
Câu 8.(Trang 54 SGK)
Hợp chất khí với hiđro của một nguyên tố là RH4, oxit cao nhất của nó chứa 53,3% oxi về khối lượng. Tìm nguyên tử khối nguyên tố đó.
Câu 9.(Trang 54SGK)
Khi cho 0,6 g một kim loại nhóm IIA tác dụng với nước tạo ra 0,336 lít khí hiđro (ở đktc). Xác định kim loại đó.
Xem thêm bài viết khác
- Giải câu 10 bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Giải thí nghiệm 2 bài 37: Bài thực hành số 6: Tốc độ phản ứng hóa học
- Giải câu 2 bài 16: Luyện tập Liên kết hóa học
- Giải câu 8 bài 32: Hidrosunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit
- Giải câu 2 bài 32: Hidrosunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit
- Giải câu 6 bài 29: Oxi Ozon
- Giải câu 5 bài 6: Luyện tập Cấu tạo vỏ nguyên tử
- Giải câu 5 bài 25: Flo Brom Iot
- Giải câu 4 bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Giải câu 7 bài 15: Hóa trị và số oxi hóa
- Giải câu 5 bài 17: Phản ứng oxi hóa khử
- Giải bài 20 hóa 10: Bài thực hành số 1 - Phản ứng oxi hóa khử











