Giải bài 27 hóa học 10: Bài thực hành số 2: Tính chất hóa học của khí clo và hợp chất của clo
Nhằm áp dụng kiến thực lí thuyết vào thực tiễn. KhoaHoc chia sẻ tới các bạn bài 27: Bài thực hành số 2: Tính chất hóa học của khí clo và hợp chất của clo . Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn
Nội dung bài học gồm hai phần
- Lý thuyết về tính chất hóa học của khí clo và hợp chất của clo
- Giải các thí nghiệm SGK
A. Lý thuyết
1. Tính chất hóa học của khí clo
a, Phương pháp điều chế
Trong phòng thí nghiệm, khí clo được điều chế bằng phương pháp:
- Đun nóng nhẹ dung dịch axit clorua đậm đặc với chất có khả năng oxy hóa mạnh như mangan đioxit (MnO2).
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
- Dùng một số chất oxy hóa khác như kali pemanganat (KMnO4), Kali Clorat (KClO3), Clorua vôi (CaOCl2).
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2

b, Tính chất hóa học
- Tác dụng với kim loại tạo ra muối clorua:
2Fe + 3Cl2 →(to) 2FeCl3
- Tác dụng với hiđro:
Cl2 + H2 →(đk: as) 2HCl (khí hiđro clorua)
- Tác dụng với nước
Cl2 + H2O ⥩ HCl + HClO (axit hipo clorơ)
2. Hợp chất của clo
a, Axit clohiđric
Tính chất hóa học:
- Là dung dịch axit mạnh làm đỏ giấy quỳ tím
Ví dụ:
Tác dụng với bazơ : NaOH + HCl → NaCl + H2O
Tác dụng với kim loại : Fe + 2HCl → FeCl2 + H2
- Có tính khử
Ví dụ: K2Cr2O7 + 14HCl (đặc) → 2CrCl3 + 3Cl2+ 2KCl + 7H2O
* Điều chế axit clohidric
- Trong phòng thí nghiệm điều chế bằng phản ứng: đun nóng muối NaCl với dung dịch H2SO4 đặc:
NaCl + H2SO4 (đặc) → (t <250oC) NaHSO4 + HCl
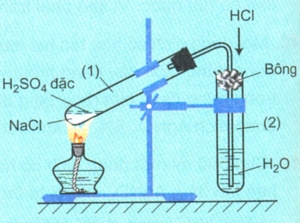
b, Muối của axit clohiđric. Nhận biết ion clorua
- Đa số muối clorua đều dễ tan trong nước, một vài muối không tan : AgCl, PbCl2 (không tan trong nước lạnh, tan khá nhiều trong nước nóng), CuCl, HgCl2
- Một số muối clorua dễ bay hơi ở nhiệt độ cao như Cu(II) clorua, sắt(III) clorua, thiếc(IV) clorua…
- Nhận biết ion clorua bằng dung dịch AgNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
AgNO3 + HCl→ AgCl↓ + HNO3
B. Giải thí nghiệm SGK
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Kiến thức thú vị
Thí nghiệm 1: Điều chế khí Clo – Tính tẩy màu của khí clo ẩm
- Quan sát hiện tượng xảy ra.
- Giải thích và viết phương trình hóa học.
Thí nghiệm 2: Điều chế axit clohidric
- Quan sát hiện tượng. Viết phương trình hóa học của phản ứng điều chế axit clohidric.
- Quan sát hiện tượng khi cho mẩu giấy quỳ tím vào dung dịch.
Thí nghiệm 3: Bài tập thực nghiệm phân biệt các dung dịch: HCl, NaCl, HNO3
Xem thêm bài viết khác
- Giải thí nghiệm 4 bài 31: Bài thực hành số 4: Tính chất hóa học của oxi, lưu huỳnh
- Giải câu 8 bài 2: Hạt nhân nguyên tử , nguyên tố hóa học, đồng vị
- Giải câu 2 bài 29: Oxi Ozon
- Giải câu 3 bài 23: Hidro clorua Axit clohidric và muối clorua
- Giải câu 1 bài 15: Hóa trị và số oxi hóa
- Giải câu 7 bài 25: Flo Brom Iot
- Giải câu 8 bài 26: Luyện tập: Nhóm halogen
- Giải câu 7 bài 21: Khái quát về nhóm Halogen
- Giải câu 6 bài 18: Phân loại phản ứng trong hóa học vô cơ
- Giải câu 3 bài 26: Luyện tập: Nhóm halogen
- Giải bài 4 hóa học 10: Cấu tạo vỏ nguyên tử
- Giải câu 8 bài 16: Luyện tập Liên kết hóa học











