Giải bài 35 hóa học 10: Bài thực hành số 5: Tính chất các hợp chất của lưu huỳnh
Nhằm áp dụng kiến thực lí thuyết vào thực tiễn. KhoaHoc chia sẻ tới các bạn bài thực hành số 5: Tính chất các hợp chất của lưu huỳnh . Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn
Nội dung bài học gồm hai phần
- Lý thuyết về tính chất các họp chất của lưu huỳnh
- Giải các thí nghiệm SGK
A. Lý thuyết
1. Tính chất của hiđro sunfua
a, Tính chất
* Tính axit yếu
- Hiđro Sunfua tan trong nước tạo thành dung dịch axit sunfuhiđric, là một axit yếu (yếu hơn H2CO3), khi tác dụng dung dịch kiềm có thể tạo thành hai loại muối: S2-, hay HS-.
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH →NaHS + H2O
* Tính khử mạnh
- Tác dụng với oxi.
2H2S + 3O2 →(to) 2SO2 + 2H2O
- Tác dụng với dung dịch brom.
H2S + 4Br2 + H2O → H2SO4 + 8HBr
(nâu đỏ) (không màu)
b, Điều chế
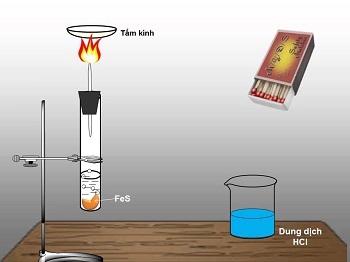
- Trong phòng thí nghiệm điều chế từ dung dịch HCl tác dụng với FeS
FeS + 2HCl → FeCl2 + H2S
2. Tính chất của lưu huỳnh đioxit (SO2)
a, SO2 là oxit axit
- SO2 tan trong nước tạo dd axit yếu:
SO2 + H2O ⥩ H2SO3
- SO2 + Bazơ → muối axit hoặc muối trung hòa, tùy vào tỉ lệ mol của chất tham gia.
NaOH + SO2 → NaHSO3 (Natri hidro sunfit)
2NaOH + SO2 → Na2SO3 (Natri sunfit) + H2O
b, SO2 là chất khử và là chất oxi hóa
- SO2 là chất khử mạnh
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
(vàng nâu) (không màu)
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
(tím) (không màu)
- SO2 là chất oxi hóa
2SO2 + H2S → 3S + 2H2O
SO2 + 2Mg → S + 2MgO
c, Điều chế
- Trong phòng thí nghiệm:
H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
3. Tính chất của axit sunfuric
a, Tính chất của dung dịch axit sunfuric loãng: đầy đủ tính chất của một axit
- Quỳ tím hoá đỏ
- Tác dụng với kim loại đứng trước H → muối + H2
- Tác dụng với bazơ và oxit bazơ → muối + H2O
- Tác dụng với muối của axit yếu hơn
b, Tính chất của axit sunfuric đặc: Tính oxi hoá mạnh
- Tác dụng với kim loại ( trừ Au, Pt):
2H2SO4 đặc + Cu → CuSO4 + SO2 + 2H2O
Chú ý: Al,Cr, Fe thụ động hóa trong H2SO4 đặc nguội.
- Tác dụng với phi kim có tính khử:
2H2SO4 + C → CO2 + 2SO2 + 2H2O
- Tác dụng với hợp chất có tính khử
3H2SO4 + H2S → 4SO2 + 4H2O
- Tính háo nước
C12H22O11 (H2SO4 đặc) → 12C + 11H2O
B. Giải các thí ngiệm SGK
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Kiến thức thú vị
Thí nghiệm 1: Điều chế - chứng minh tính khử của H2S
- Quan sát hiện tượng, viết phương trình hóa học.
- Xác định vai trò các chất tham gia phản ứng.
Thí nghiệm 2: Tính khử của SO2
- Quan sát hiện tượng, viết phương trình hóa học.
- Xác định vai trò các chất tham gia phản ứng.
Thí nghiệm 3: Tính oxi hóa của SO2
- Quan sát hiện tượng, viết phương trình hóa học.
- Xác định vai trò các chất tham gia phản ứng.
Thí nghiệm 4: Tính oxi hóa của H2SO4 đặc
- Quan sát hiện tượng, viết phương trình hóa học.
- Xác định vai trò các chất tham gia phản ứng.
Xem thêm bài viết khác
- Giải câu 5 bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Giải câu 4 bài 25: Flo Brom Iot
- Giải câu 1 bài 21: Khái quát về nhóm Halogen
- Giải câu 6 bài 21: Khái quát về nhóm Halogen
- Giải câu 8 bài 11: Luyện tập Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Giải câu 4 bài 32: Hidrosunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit
- Giải câu 11 bài 26: Luyện tập: Nhóm halogen
- Giải thí nghiệm 3 bài 35: Bài thực hành số 5: Tính chất các hợp chất của lưu huỳn
- Giải câu 3 bài 34: Luyện tập: Oxi và lưu huỳnh
- Giải bài 37 hóa học 10: Bài thực hành số 6: Tốc độ phản ứng hóa học
- Giải câu 7 bài 6: Luyện tập Cấu tạo vỏ nguyên tử
- Giải câu 2 bài 16: Luyện tập Liên kết hóa học











