-
Tất cả
-
 Tài liệu hay
Tài liệu hay
-
 Toán Học
Toán Học
-
 Soạn Văn
Soạn Văn
-
Soạn đầy đủ
- Tiếng Việt 2 tập 2 KNTT
- Tiếng Việt 2 CTST
- Tiếng Việt 2 sách Cánh Diều
- Tiếng Việt 3 tập 2
- Tiếng Việt 3 tập 1
- Tiếng Việt 4 tập 2
- Tiếng Việt 4 tập 1
- Tiếng Việt 5 tập 2
- Tiếng Việt 5 tập 1
- Soạn văn 6
- Soạn văn 7
- Soạn văn 8 tập 1
- Soạn văn 8 tập 2
- Soạn văn 9 tâp 1
- Soạn văn 9 tập 2
- Soạn văn 10 tập 1
- Soạn văn 10 tập 2
- Soạn văn 11
- Soạn văn 12
-
Soạn ngắn gọn
- Soạn văn 12 ngắn gọn tập 1
- Soạn văn 12 ngắn gọn tập 2
- Soạn văn 11 ngắn gọn tập 1
- Soạn văn 11 ngắn gọn tập 2
- Soạn văn 10 ngắn gọn tập 1
- Soạn văn 10 ngắn gọn tập 2
- Soạn văn 9 ngắn gọn tập 1
- Soạn văn 9 ngắn gọn tập 2
- Soạn văn 8 ngắn gọn tập 1
- Soạn văn 8 ngắn gọn tập 2
- Soạn văn 7 ngắn gọn tập 1
- Soạn văn 7 ngắn gọn tập 2
- Ngữ văn VNEN
- Đề thi THPT QG môn Ngữ Văn
-
Soạn đầy đủ
-
 Tiếng Anh
Tiếng Anh
-
 Vật Lý
Vật Lý
-
 Hóa Học
Hóa Học
-
 Sinh Học
Sinh Học
-
 Lịch Sử
Lịch Sử
-
 Địa Lý
Địa Lý
-
 GDCD
GDCD
-
 Khoa Học Tự Nhiên
Khoa Học Tự Nhiên
-
 Khoa Học Xã Hội
Khoa Học Xã Hội
-
Giải bài 11: Axit photphoric và muối photphat
Bài học này trình bày nội dung: Axit photphoric và muối photphat . Dựa vào cấu trúc SGK hóa học lớp 9, KhoaHoc sẽ tóm tắt lại hệ thống lý thuyết và hướng dẫn giải các bài tập 1 cách chi tiết, dễ hiểu. Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn.
A - KIẾN THỨC TRỌNG TÂM
AXIT PHOTPHORIC
I.Cấu tạo phân tử và tính chất vật lí
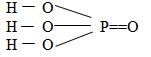
- Trong hợp chất H3PO4, Photpho có số oxi hóa cao nhất là +5
- Acid photphoric là tinh thể trong suốt, nóng chảy ở 42,5oC.
- Rất háo nước và tan vô hạn trong nước.
II.Tính chất hóa học
1.Acid Photphoric là acid 3 nấc, có độ mạnh trung bình. Nó có tất cả những tính chất chung của acid.
![]()
![]()
![]()
- Trong dung dịch , H3PO4 có các ion:
- H2PO4- : dihidrophotphat
- HPO42- : hidrophotphat
- PO43- : photphat và ion H+
2.Tác dụng với dung dịch kiềm
- Tùy theo lượng chất tác dụng mà acid photphoric tạo ra muối acid, muối trung hòa hoặc hỗn hợp mưới đó. Ví dụ;
H3PO4 + NaOH → Na H2PO4 + H2O
H3PO4 + NaOH → Na2 HPO4 + 2H2O
H3PO4 + NaOH → Na 3PO4 + 3H2O
3.Acid photphoric không có tính oxi hóa.
III.Điều chế
1.Trong phòng thí nghiệm
![]()
2.Trong công nghiệp
- Đi từ quặng photphorit hoặc apatit.
Ca3(PO4)2 + 3H2SO4 đặc →(to) 2 H3PO4 + 3CaSO4↓
- Đi từ photpho: có độ tinh khiết và nồng độ cao hơn.
P + 5O2 →(to) 2P2O5
P2O5 + 3 H2O → 2 H3PO4
IV.Ứng dụng
- Điều chế muối photphat, sản xuất phân lân, thuốc trừ sâu, dược phẩm
MUỐI PHOTPHAT
Các loại muối photphat
- Muối photphat trung hòa: Na3PO4, (NH4)3PO4, Ca3(PO4)2 ,...
- Muối acid:
- Muối hidrophotphat: Na2HPO4, CaHPO4, (NH4)2HPO4,…
- Muối dihidrophotphat: NaH2PO4, Ca(H2PO4)2, NH4H2PO4,…
I.Tính tan
- Các muối trung hòa và các muối acid của kim loại Natri, Kali nà Amoni đều tan trong nước.
- Với các kim loại khác, chỉ có muối dihidrophotphat là tan được, ngoài ra đều không tan hoặc ít tan trong nước.
II.Nhận biết ion photphat
- Dùng AgNO3 làm thuốc thử để nhận biết các muối photphat tan.
3Ag+ + PO43- → AgPO4↓ vàng
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Kiến thức thú vị
Câu 1.(Trang 53 /SGK)
Viết phương trình hóa học dạng phân tử và dạng ion rút gọn của phản ứng giữa H3PO4 với lượng dư của:
a) BaO
b) Ca(OH)2
c) K2CO3
Câu 2.(Trang 53 /SGK)
Nêu những điểm giống nhau và khác nhau về tính chất hóa học giữa axit nitric và axit photphoric. Dẫn ra những phản ứng hóa học để minh họa.
Câu 3 .(Trang 54 /SGK)
Phương trình điện li tổng cộng của H3PO4 trong dung dịch là:
H3PO4 ⇌ 3H+ + PO43-
Khi thêm HCl vào dung dịch:
A. Cân bằng trên chuyển dịch theo chiều thuận.
B. Cân bằng trên chuyển dịch theo chiều nghịch.
C. Cân bằng trên không bị dịch chuyển.
D. Nồng độ PO43- tăng lên.
Câu 4.(Trang 54 /SGK)
Lập phương trình hóa học sau đây:
a) H3PO4 + K2HPO4 →
1 mol 1 mol
b) H3PO4 + Ca(OH)2 →
1 mol 1 mol
c) H3PO4 + Ca(OH)2 →
2 mol 1 mol
d) H3PO4 + Ca(OH)2 →
2 mol 3 mol
Câu 5.(Trang 54 /SGK)
Để thu được muối photphat trung hòa, cần lấy bao nhiêu ml dung dich NaOH 1,00 M cho tác dụng với 50,0 ml dung dịch H3PO4 0,50 M ?
=> Trắc nghiệm hóa học 11 bài 11: Axit photphoric và muối photphat
-
KNO3 là chất điện li mạnh hay yếu Viết phương trình điện li của chất KNO3
-
Danh pháp các hợp chất hữu cơ Cách đọc tên hợp chất hữu cơ
-
Chất nào sau đây là chất điện li yếu Chất điện li yếu
-
Đề thi Olympic lớp 11 môn Hóa học Sở GD&ĐT Quảng Nam Đề thi chọn HSG lớp 11 môn Hóa
- Ở đây bạn có thể tìm thấy: ôn tập kiến thức trọng tâm Hóa học 11, hướng dẫn giải bài tập SGK Hóa học 11 một cách dễ hiểu, các dạng chuyên đề thường gặp trong Hóa 11, tuyển tập các đề thi môn hóa học kỳ 1 - học kỳ 2 mới nhất
- CHƯƠNG 1: SỰ ĐIỆN LI
- CHƯƠNG 2: NITO - PHOTPHO
- CHƯƠNG 3: CACBON - SILIC
- CHƯƠNG 4: ĐẠI CƯƠNG VỀ HÓA HỮU CƠ
- CHƯƠNG 5: HIDROCACBON NO
- CHƯƠNG 6: HIDROCACBON KHÔNG NO
- CHƯƠNG 7: HIDROCACBON THƠM, NGUỒN HIDROCACBON THIÊN NHIÊN. HỆ THỐNG HÓA VỀ HIDROCACBON
- CHƯƠNG 8: DẪN XUẤT HALOGEN - ANCOL - PHENOL
- CHƯƠNG 9: ANDEHIT - XETON - AXIT CACBOXYLIC











